OXAPROL

OXAPROLOxaprolines Polyfonctionnelles : Synthèse Asymétrique via Cycloaddition Dipolaire-1,3, Evaluation en tant que Nouveaux Organocatalyseurs et Précurseurs d’Aminoacides Disubstitués et Contraints.
Résumé
Oxaprolines : sources synthétiques pour de nouveaux aminoacides et catalyseurs organiques
Les enzymes, catalyseurs de la chimie du vivant, constituent à la fois des modèles pour le chimiste et des éléments clés dans tous les processus biologiques. Proposer des analogues simples de ces enzymes constitue un défi pour la chimie de synthèse avec des répercussions attendues dans le domaine pharmaceutique.
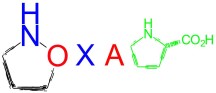
Accès à des analogues oxygénés de la proline à potentiel synthétique et biologique.
Ce projet vise :
1- à maîtriser une réaction péricyclique dans une version inédite à haut potentiel synthétique permettant l’accès à des structures proches de celle de la proline en peu d’étapes.
2- à développer de nouveaux catalyseurs purement organiques (non métalliques).
3- à réaliser la synthèse d’aminoacides non naturels inédits et de petits peptides correspondants, en vue d'applications d’ordre biologique (évaluation d’aminoacides contraints comme inducteurs conformationnels de peptides, de cyclodipeptides en tant qu’inhibiteurs d’enzymes dimériques, oligomérisation d’oxaprolines pour l’élaboration de foldamères).
Le succès des objectifs 2 et 3 et des applications qui en découlent est conditionné à la possibilité de parvenir aux molécules issues de la réaction péricyclique-clé avec la (stéréo)sélectivité requise (objectif 1).
L’enjeu est donc à la fois d’intérêt fondamental (parvenir à contrôler asymétriquement la formation d’une molécule hétérocyclique complexe) et applicatif.
Oxaprolines : synthèse contrôlée, organocatalyse et incorporation dans de petits peptides
Ce projet doit au préalable permettre la synthèse asymétrique d’oxaprolines possédant un centre quaternaire. L’accès rapide à ce squelette de base est réalisé par cycloaddition [3+2] de cétonitrones fonctionnelles dont le contrôle (notamment celui de l’énantiosélectivité) est abordé par deux approches : la première fait usage de substrats équipés d’un auxiliaire chiral. Cette méthode, plus directe, nous permet d’accéder le plus rapidement aux molécules désirées. La seconde approche, plus ambitieuse, est basée sur des réactions activées par des catalyseurs chiraux, et nos premiers résultats que le succès de cette approche nécessite une percée conceptuelle par rapport à l’état de l’art.
Une fois définis les chemins d'accès aux différentes oxaprolines, nous allons réaliser leur évaluation en organocatalyse (axe 2) et en chimie peptidomimétique (axe 3).
En ce qui concerne l’axe 2, les dérivés d’oxaproline vont être testés en organocatalyse par comparaison avec la proline et d’autres organocatalyseurs de référence. L’optimisation de l’activité organocatalytique est envisagée grâce à l’utilisation de nombreux dérivés mais également par l’incorporation de ces oxaprolines dans des tripeptides.
Nous travaillons également à la synthèse d’oligomères de ces oxaprolines pour en étudier les propriétés d’hélicité (axe 3).
Point essentiel, les oxaprolines ciblées peuvent être fonctionnellement et structurellement modifiées (ouverture de l’hétéroliaison) pour donner des aminoacides disubstitués à forte contrainte stérique et pourvues de chaînes latérales permettant différentes interactions (liaisons hydrogène notamment). Ceux-ci vont être dimérisés sous forme cyclique et évalués en tant qu’inhibiteurs d’enzymes. D’autres champs d’application sur le plan biologique de ces nouveaux acides aminés seront explorées à moyen terme, par l’étude des restrictions conformationnelles consécutives à leur incorporation dans des séquences peptidiques.