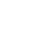Gaulon-Nourry, Catherine

Gaulon-Nourry, Catherine

Parcours
Depuis 2006 : Maître de Conférences - UFR Sciences, Université du Maine.
Recherche : IMMM, équipe Méthodologies et Synthèse organique.
Groupe : Dr. Pascal Gosselin, Dr. Gilles Dujardin.
2005-2006 : ATER, UFR Sciences, Université du Maine, Le Mans.
Recherche : IMMM, équipe Méthodologies et Synthèse organique.
Groupe : Dr Gilles Dujardin.
Vers l’élaboration de synthons C1-C11 du péloruside A et d’analogues.
2004-2005 : Post-doctorat, The Institute of Cancer Research, Sutton, Surrey, UK.
Équipe : Pr. Caroline J. Springer.
Synthèse d’inhibiteurs de la protéine-kinase B-RAF.
2000-2003 : Doctorat, Université du Maine, Bourse MESR, moniteur CIES.
Groupe : Dr Gilles Dujardin, Pr. Robert Dhal.
N-vinyl-2-oxazolidinones : nouveaux diénophiles en hétérocycloaddition
[4+2]. Application à la synthèse asymétrique de N-glucosides originaux.
Activités de recherche
Synthèse de molécules à visée anticancéreuse
Analogues du péloruside A
C. Gaulon-Nourry, A.-C. Chany (post-doctorante), F. Legros, P. Gosselin, G. Dujardin
Notre projet vise à construire des molécules macrocycliques originales, basées sur le squelette du péloruside A, un puissant agent antimitotique d’origine marine. Notre but est d’enrichir l’étude de la relation structure-activité de cette molécule prometteuse, mais présentant une structure complexe et peu disponible à l’état naturel. Dans ce contexte, nous avons mis au point une stratégie d’accès innovante et très convergente à des "plateformes synthétiques" macrocycliques originales, offrant de nombreuses perspectives de fonctionnalisation vers des analogues originaux du péloruside A. Notre stratégie convergente à trois fragments, déjà validée par l’obtention de plusieurs analogues, est basée sur une nouvelle méthodologie de double aldolisation croisée sur des diazoacétones silylées développée parallèlement dans l’équipe.
Ce projet, qui s’inscrit dans l’axe "Valorisation des Produits de la Mer en Cancérologie" du Cancéropôle Grand-Ouest, est mené en collaboration interrégionale avec les équipes de Jacques Lebreton et Monique Mathé-Allainmat à Nantes (CEISAM, équipe Symbiose) et de Bertrand Carboni à Rennes (SCR, Equipe IMCV)
Développement de nouvelles méthodologies en synthèse organique
Développements synthétiques des α-trialkylsilyl-α-diazoacétones
C. Gaulon-Nourry, I. Abid (doctorante), F. Legros, P. Gosselin, G. Dujardin.
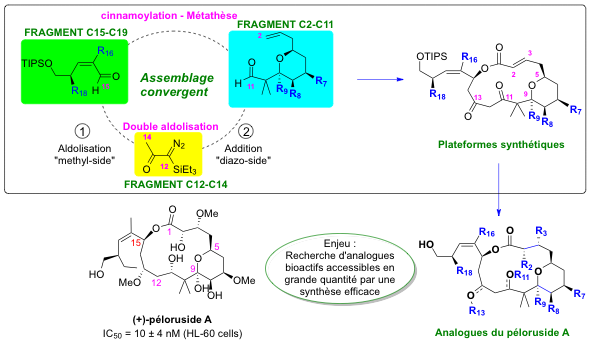
En connexion avec notre projet de synthèse totale d'analogues du péloruside A, nous explorons le potentiel synthétique des α-trialkylsilyl-α-diazocétones, jusqu’alors connues comme précurseurs de silylcétènes. Nous avons notamment montré que ce building-block à 3 carbones pouvait être inséré dans une chaîne carbonée en respectant la fonctionnalité diazo, par aldolisation methyl-side en milieu basique, puis addition nucléophile en milieu basique du carbone diazoté (diazo-side) après déprotection. Le groupement diazo, préservé jusqu’alors, est ensuite une source de diversité fonctionnelle bien connue pour la position diazotée. Nous travaillons actuellement à une nouvelle approche dans laquelle le groupement silylé porté par la position diazotée permet de générer l’anion par activation nucléophile douce à l'aide d'un fluorure. Cette approche inédite sur les diazocétones silylées s’est avérée très efficace avec divers substrats aldéhydiques, en utilisant le TBAF comme source de fluorure. L’idée est de pouvoir travailler dans des conditions douces et peu basiques, avec une mise en œuvre expérimentale facile. Cette méthodologie offre une perspective d’extension asymétrique par l’utilisation d’un contre-ion chiral pour le fluorure, aspect qui est mené en collaboration avec le Dr. D. Cahard (Laboratoire COBRA, Université de Rouen).
Activités d'enseignement
Lieux d'enseignement : UFR-Sciences et IUT Chimie, Université du Maine.
Organisation du service d'enseignement : 50% CM, 40% TD, 10% TP
Modules enseignés :
- L2 Physique-Chimie : Chimie organique (CM/TD)
- L3 Chimie et Biologie : Chimie organique (CM/TD), réactions péricycliques (CM/TD), RMN (CM/TD).
- LPro : Réactions péricycliques (CM/TD), RMN (CM/TD).
- M1 Chimie : Synthèse hétérocyclique (CM/TD), Sélectivités et protections en synthèse organique (TD), Synthèse asymétrique (CM/TD), RMN (CM/TD), TP de synthèse organique.
- M2 Chimie : Synthèse asymétrique (CM), RMN (CM).
Responsabilités pédagogiques :
Responsable du Master 2 ChiMaNa, spécialité Chimie Fine.
Mise en place d’une double-diplômation L3-M1 avec l’Université Nationale du Vietnam à Ho Chi Minh ville. Co-responsable de 2009 à 2013.
Publications
- TBAF-Triggered Aldol-Type Addition of α-triethylsilyl-α-diazoacétone (Catherine Gaulon-Nourry - I. Abid - P. Gosselin - M. Mathé-Allainmat - S. Abid - G. Dujardin - C. Gaulon-Nourry, 2015)
J. Org. Chem. 2015, 80, 9980-9988.
- Convergent Strategy Towards the Synthesis of Restricted Analogues of Peloruside A (Catherine Gaulon-Nourry - N. Zimmermann - P. Pinard - B. Carboni - P. Gosselin - C. Gaulon-Nourry - G. Dujardin - S. Collet - J. Lebreton - M. Mathé-Allainmat, 2013)
Eur. J. Org. Chem. 2013, 2303-2315.
- 3. 1,3-Dipolar Cycloadditions of Nitrones to Hetero-substituted Alkenes Part 2: Sila-, Thia-, Phospha- and Halo-substituted Alkenes. (Catherine Gaulon-Nourry - T. B. Nguyen - A. Martel - C. Gaulon-Nourry - R. Dhal - G. Dujardin, 2012)
Organic Preparations and Procedures International (O.P.P.I), 2012, 44, 1-81.
- Tandem Payne/meinwald versus Meinwald rearrangements on the α-hydroxy- or α-silyloxy-spiro epoxide skeleton. (Catherine Gaulon-Nourry - J. Totobenazara - H. Haroun - J. Rémond - K. Adil - F. Dénès - J. Lebreton - C. Gaulon-Nourry - P. Gosselin, 2012)
Org. Biomol. Chem. 2012, 10, 502.
- α−Triethylsilyl-α-diazoacetone in double cross-aldolisation: convenient acetone equivalent toward 5-hydroxy-1,3 diketones. (Catherine Gaulon-Nourry - A. Lancou - H. Haroun - U. K. Kundu - F. Legros - N. Zimmermann - M. Mathé-Allainmat - J. Lebreton - G. Dujardin - C. Gaulon-Nourry - P. Gosselin, 2012)
Tetrahedron 2012, 68, 9652-9657.
- 1,3-Dipolar cycloadditions of nitrones to heterosubstituted alkenes. Part 1: oxa- and aza-substituted alkenes. (Catherine Gaulon-Nourry - T. B. Nguyen - A. Martel - C. Gaulon-Nourry - R. Dhal - G. Dujardin, 2010)
Organic Preparations and Procedures International (O.P.P.I), 2010, 42, 1-45.
- Development of novel, highly potent inhibitors of V-RAF murine sarcoma viral oncogene homologue B1 (BRAF): increasing cellular potency through optimization of a distal heteroaromatic group. (Catherine Gaulon-Nourry - B. M. J. M. Suijkerbuijk - I. Niculescu-Duvaz - C. Gaulon - H. P. Dijkstra - D. Niculescu-Duvaz - D. Ménard - A. Zambon - A. Nourry - L. Davies - H. Manne - F. Friedlos - L. M. Ogilvie - D. Hedley - F. Lopes - N. P. U. Preece - J. Moreno-Farre - F. I. Raynaud - R. Kirk - S. Whittaker - R. Marais - C. J. Springer, 2010)
J. Med. Chem. 2010, 53, 2741-2756.
- BRAF inhibitors based on an imidazo[4,5]pyridin-2-one scaffold and a meta substituted middle ring. (Catherine Gaulon-Nourry - A. Nourry - A. Zambon - L. Davies - I. Niculescu-Duvaz - H. P. Dijkstra - D. Ménard - C. Gaulon - D. Niculescu-Duvaz - B. M. J. M. Suijkerbuijk - F. Friedlos - H. Manne - R. Kirk - S. Whittaker - R. M. Marais - C. J. Springer, 2010)
J. Med. Chem. 2010, 53, 1964-1978.
- Pyridoimidazolones as Novel Potent Inhibitors of v-Raf Murine Sarcoma Viral Oncogene Homologue B1 (BRAF). (Catherine Gaulon-Nourry - D. Niculescu-Duvaz - C. Gaulon - H. P. Dijkstra - I. Niculescu-Duvaz - A. Zambon - D. Ménard - B. M. J. M. Suijkerbuijk - A. Nourry - L. Davies - H. Manne - F. Friedlos - L. Ogilvie - D. Hedley - S. Whittaker - R. Kirk - A. Gill - R. D. Taylor - F. I. Raynaud - J. Moreno-Farre - R. Marais - C. J. Springer., 2009)
J. Med. Chem. 2009, 52, 2255-2264.